7月5日、ノボ ノルディスクは中国でカグリセマ注射剤の第III相臨床試験を開始した。その目的は、中国の肥満および過体重患者におけるカグリセマ注射剤とセメグルチドの安全性と有効性を比較することである。
カグリセマ注射はノボ ノルディスクが開発中の長時間作用型併用療法で、主成分はGLP-1(グルカゴン様ペプチド-1)受容体作動薬スメグルチドと長時間作用型アミリン類似体カグリリンチドです。CagriSema注射は、週に1回皮下投与できます。
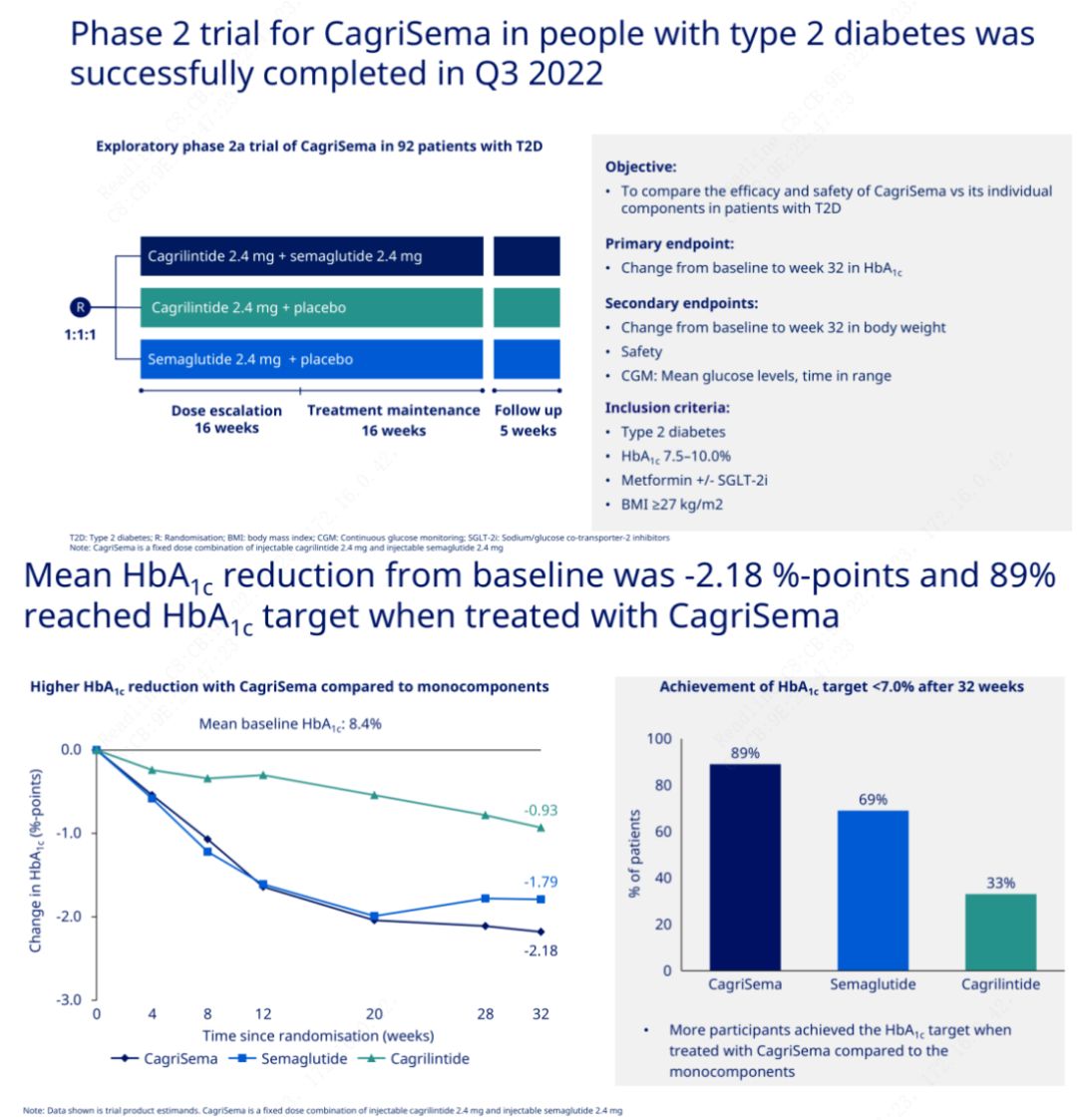
主な目的は、CagriSema (2.4 mg/2.4 mg) をセメグルチドまたはプラセボと週 1 回皮下で比較することでした。ノボ ノルディスクは、ステージ 2 糖尿病の治療を目的とした CagriSema の臨床試験の結果を発表しました。この結果、CagriSema の血糖降下効果はセメグルチドよりも優れており、被験者のほぼ 90% が HbA1c の目標を達成したことが証明されました。
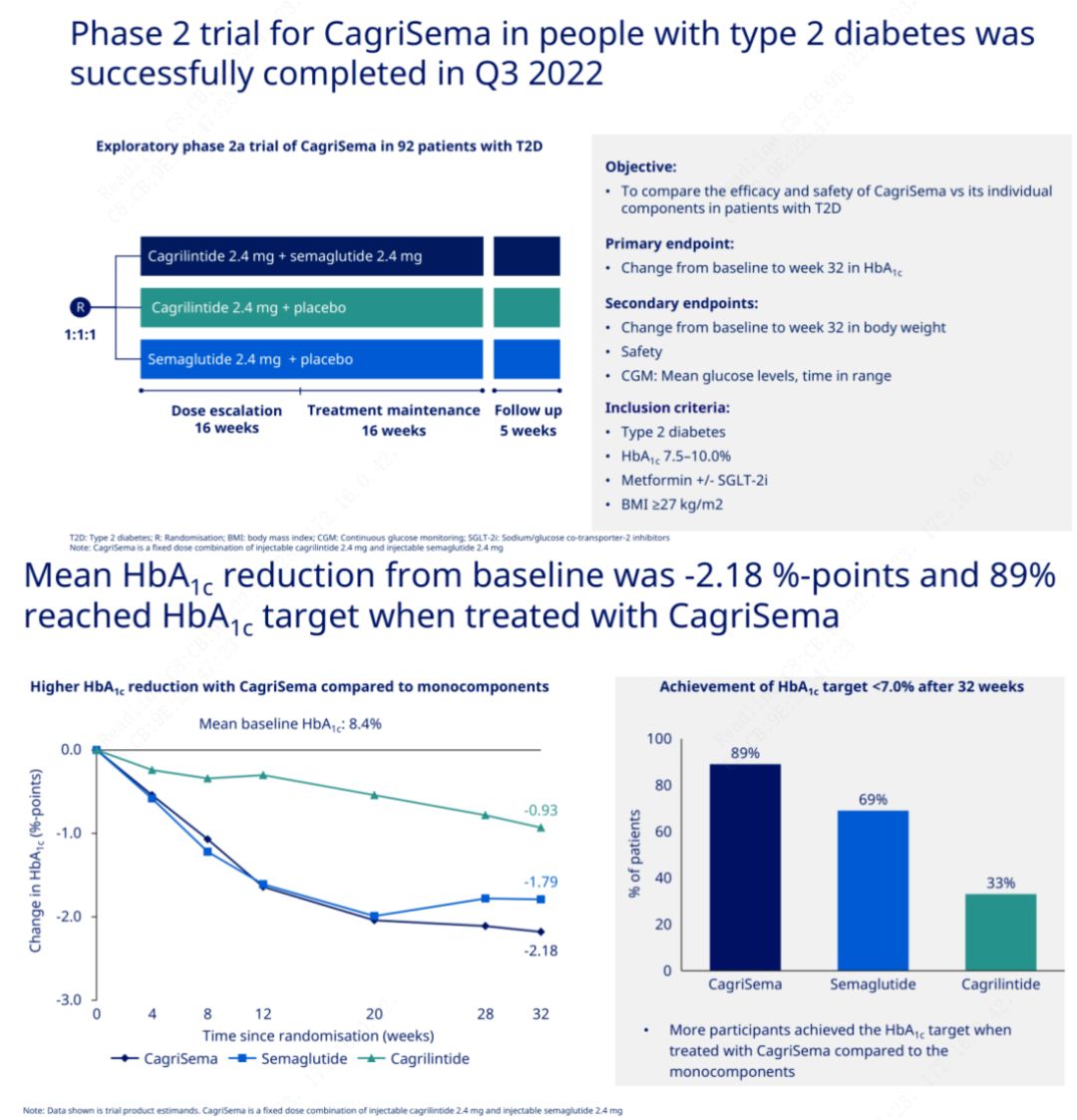
データは、顕著な血糖降下効果に加えて、体重減少の点で、カグリセマ注射がセメグルチド (5.1%) およびカグリリンチド (8.1%) を大幅に上回り、体重減少が 15.6% であることを示しました。
革新的な薬剤チルゼパチドは、世界で初めて承認された毎週の GIP/GLP-1 受容体アゴニストです。これは、2 つのインクレチンの効果を 1 つの分子に組み合わせたもので、週に 1 回注射され、2 型糖尿病の新しい種類の治療法です。チルゼパチドは、成人 2 型糖尿病の血糖コントロール(食事ベースおよび運動)を改善する目的で 2022 年 5 月に米国食品医薬品局 (FDA) によって承認され、現在、欧州連合、日本およびその他の国で承認されています。
7月5日、イーライリリーは、2型糖尿病患者の治療のための医薬品臨床試験登録および情報開示プラットフォームに関する第III相SURPASS-CN-MONO試験を発表した。SURPASS-CN-MONOは、2型糖尿病患者を対象に、プラセボと比較したチルゼパチド単独療法の有効性と安全性を評価するために設計されたランダム化二重盲検プラセボ対照第III相試験です。この研究には、訪問 1 までの 90 日間にいかなる抗糖尿病薬も服用していない 2 型糖尿病患者 200 名が参加する予定でした(急性疾患、入院、短期手術などの特定の臨床状況を除く)。日)インスリンの使用)。
2型糖尿病は今年承認される見込み
先月、SURPASS-AP-Combo 研究の結果が大ヒット雑誌 Nature Medicine に 5 月 25 日に掲載されました。その結果、インスリングラルギンと比較して、ティルゼパチドは、アジア太平洋地域(主に中国)の2型糖尿病患者集団において、より優れたHbA1cと体重減少を示したことが示されました。HbA1cは最大2.49%減少し、体重は最大7.2kg減少しました。 (9.4%) 40 週間の治療で血中脂質と血圧が大幅に改善し、全体的な安全性と忍容性は良好でした。
SURPASS-AP-Comboの第3相臨床試験は、北京大学人民病院のJi Linong教授が主導し、主に中国人の2型糖尿病患者を対象に実施されたティルゼパチドの最初の研究である。SURPASS-AP-Comboは、世界的なSURPASSシリーズの研究結果と一致しており、中国人患者の糖尿病の病態生理学が世界の患者の病態生理学と一致していることがさらに証明され、これが新薬の同時研究開発の基礎となります。また、中国人患者に最新の糖尿病治療薬を使用する機会を与え、中国での臨床応用をできるだけ早く提供するための確かな証拠のサポートも提供します。
投稿日時: 2023 年 9 月 18 日

